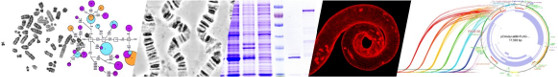
Механизмы кинетохор-зависимого образования микротрубочек у Drosophila
Для выполнения проекта "Механизмы кинетохор-зависимого образования микротрубочек у Drosophila" в ИМКБ была создана Лаборатория клеточного деления
 |
Финансирование проекта в 2014-2016 гг осуществлялось из |
|
|
ВЕДУЩИЙ УЧЕНЫЙ |
ИСПОЛНИТЕЛИ
|
Алексеева Анастасия Леонидовна |
Лещенко Анна Евгеньевна |

ОБЛАСТЬ ИССЛЕДОВАНИЙ
Проект направлен на изучение митоза – процесса деления соматических клеток эукариот, который обеспечивает точную передачу генетической информации дочерним клеткам. Модельным организмом для данного проекта является Drosophila melanogaster. Поскольку большинство белков, необходимых для деления клеток, являются эволюционно консервативными, то полученные результаты прояснят механизмы формирования веретена деления и в клетках человека, что может иметь существенное значение, в частности, для терапии рака.
Расхождение сестринских хроматид в ходе мейоза осуществляется при помощи высоко динамичной клеточной структуры – веретена деления, которое соединяет хроматиды с полюсами делящейся клетки – центросомами. Веретено формируется из микротрубочек, в построении которых задействованы продукты сотен генов. На данный момент изучено лишь небольшое число генов, контролирующих этапы митоза. Выявление и детальная характеристика всех генов, вовлечённых в этот процесс, является актуальной задачей.
Микротрубочки растут в двух направлениях: от центросом и от самих хромосом. Рост последних инициируется структурами, формирующимися на хромосомах – кинетохорами. Знания о факторах, существенных для роста микротрубочек от хромосом и от кинетохоров, на текущий момент, ограничены и фрагментарны. Один из методов анализа механизмов формирования микротрубочек от кинетохоров заключается в исследовании процесса повторного роста микротрубочек после их разрушения под воздействием холода.
На первых этапах выполнения проекта был проведен детальный анализ повторного роста микротрубочек в культуре клеток S2 Drosophila melanogaster после их деполимеризации, вызванной как обработкой клеток колцемидом, так и воздействем низких температур. Полученные данные расширили спектр методических подходов к изучению роста микротрубочек от кинетохоров. Используя как классические, так и вновь разработанные методики, было исследовано влияния РНК-интерференции генов, предположительно участвующих в росте микротрубочек веретена деления от кинетохоров, на формирование веретена деления и сам процесс деления клеток.
Методом РНК-интерференции была проведена серия экспериментов по истощению белков-кандидатов в клетках S2 и последующему анализу процесса клеточного деления. Было исследовано влияние на митоз РНК-интерференции генов Eb1, Klp10A, Klp59C, Klp59D, Klp61F, Klp67A, Asp, Patronin/Ssp4, Mei-38/Ssp1/D-TPX2, Mars/D-HURP, Mast|Orbit, CG7993/Non3, Borr, CG17293, Chc, Clc, Rcd1, Rcd5 и MBD-R2.
Для изучения прижизненной динамики микротрубочек веретена деления была получена стабильная культура клеток S2, в которой экспрессируется химерный белок EB1-GFP, маркирующий “+”-концы микротрубочек веретена деления (видео 1). Эта линия использована в экспериментах по холодовой обработке (видео 2) и обработке колцемидом (видео 3) для изучения повторного роста микротрубочек от кинотохоров.
 (1)
(1)  (2)
(2) (3)
(3)
Методом просвечивающей электронной микроскопии был проведен ультраструктурный анализ области кинетохоров на каждой стадии митоза клеток S2. Методика фиксации образцов была адаптирована для суспензионной культуры и были проанализировали несколько сотен клеток, находящихся на разных стадиях митоза. В результате анализа срезов было выявлено множество структурных деталей митотического деления и построен детальный портрет процесса митоза на ультраструктурном уровне. Также было проведено исследование делящихся клеток S2 со сниженным количеством белков, которые по нашим данным влияют на рост микротрубочек от кинетохоров. Используемый подход впервые позволил детально описать на ультраструктурном уровне митоз в культивируемых клетках дрозофилы.
ПУБЛИКАЦИИ
-
Razuvaeva AV, Graziadio L, Palumbo V, Pavlova GA, Popova JV, Pindyurin AV, Bonaccorsi S, Somma MP, Gatti M. The multiple mitotic roles of the ASPM orthologous proteins: Insight into the etiology of ASPM-dependent microcephaly. Cells 12(6): 922, 2023
-
Popova JV, Pavlova GA, Razuvaeva AV, Yarinich LA, Andreyeva EN, Anders AF, Galimova YA, Renda F, Somma MP, Pindyurin AV, Gatti M. Genetic control of kinetochore-driven microtubule growth in Drosophila mitosis. Cells 11(14): 2127, 2022
-
Pavlova GA, Popova JV, Andreyeva EN, Yarinich LA, Lebedev MO, Razuvaeva AV, Dubatolova TD, Oshchepkova AL, Pellacani C, Somma MP, Pindyurin AV, Gatti M. RNAi-mediated depletion of the NSL complex subunits leads to abnormal chromosome segregation and defective centrosome duplication in Drosophila mitosis. PLoS Genet 15(9): e1008371, 2019
-
Pavlova GA, Razuvaeva AV, Popova JV, Andreyeva EN, Yarinich LA, Lebedev MO, Pellacani C, Bonaccorsi S, Somma MP, Gatti M, Pindyurin AV. The role of Patronin in Drosophila mitosis. BMC Mol Cell Biol 20 (Suppl 1): 7, 2019
-
Strunov A, Boldyreva LV, Andreyeva EN, Pavlova GA, Popova JV, Razuvaeva AV, Anders AF, Renda F, Pindyurin AV, Gatti M, Kiseleva E. Ultrastructural analysis of mitotic Drosophila S2 cells identifies distinctive microtubule and intracellular membrane behaviors. BMC Biol 16: 68, 2018 Additional TEM Data
-
Renda F, Pellacani C, Strunov A, Bucciarelli E, Naim V, Bosso G, Kiseleva E, Bonaccorsi S, Sharp DJ, Khodjakov A, Gatti M, Somma MP. The Drosophila orthologue of the INT6 oncoprotein regulates mitotic microtubule growth and kinetochore structure. PLoS Genet 13(5): e1006784, 2017
-
Omelyanchuk LV, Munzarova AF. Theoretical model of mitotic spindle microtubule growth for FRAP curve interpretation. BMC Syst Biol 11(Suppl 1): 3, 2017
-
Strunov A, Boldyreva LV, Pavlova GA, Pindyurin AV, Gatti M, Kiseleva E. A simple and effective method for ultrastructural analysis of mitosis in Drosophila S2 cells. MethodsX 3: 551-559, 2016
-
Павлова ГА, Попова ЮВ, Мунзарова АФ, Галимова ЮА, Разуваева АВ, Ренда Ф, Сомма МП, Пиндюрин АВ, Гатти М. Факторы, обусловливающие характер повторного роста микротрубочек веретена деления после деполимеризации тубулина у Drosophila melanogaster. Acta Naturae спецвыпуск (2): 70, 2016
-
Попова ЮВ, Павлова ГА, Мунзарова АФ, Разуваева АВ, Ренда Ф, Сомма МП, Пиндюрин АВ, Гатти М. Исследование генетического контроля кинетохор-зависимого роста микротрубочек в культуре клеток S2 Drosophila melanogaster при помощи РНК-интерференции. Acta Naturae спецвыпуск (2): 71, 2016
-
Munzarova A, Popova J, Razuvaeva A, Shloma V, Gatti M, Omelyanchuk L. Accurate measurement of poleward microtubule flux in the spindle of Drosophila S2 cells. Cell Biol Int 40: 984-990, 2016
-
Pavlova GA, Galimova YuA, Popova YuV, Munzarova AF, Razuvaeva AV, Alekseeva AL, Berkaeva MB, Pindyurin AV, Somma MP, Gatti M, Renda F. Factors governing the pattern of spindle microtubule regrowth after tubulin depolymerization. Цитология 58: 299-303, 2016
-
Andreyeva EN, Pechkovsky EV, Pindyurin AV, Gatti M. Pathways of spindle formation in Drosophila mitotic and meiotic cells. Цитология 58: 295-298, 2016
-
Pindyurin AV, Gatti M. Chromosomes in the taiga. Chromosome Res 23: 641-647, 2015
-
Мариловцева ЕВ, Омельянчук ЛВ. Ген hrs и границы компартментов имагинального крылового диска Drosophila melanogaster. Генетика 51: 1207-1211, 2015
-
Мариловцева ЕВ, Дубатолова ТД, Галимова ЮА, Копыл СА, Омельянчук ЛВ. Исследование клеточной локализации Hrs и других маркеров эндосом в сперматогенезе Drosophila melanogaster с помощью химерных GFP конструктов. Цитология 57(7): 509-517, 2015
-
Palumbo V, Pellacani C, Heesom KJ, Rogala KB, Deane CM, Mottier-Pavie V, Gatti M, Bonaccorsi S, Wakefield JG. Misato controls mitotic microtubule generation by stabilizing the Tubulin Chaperone Protein-1 complex. Current Biology 25(13): 1777-1783, 2015
-
Mengoli V, Bucciarelli E, Lattao R, Piergentili R, Gatti M, Bonaccorsi S. The analysis of mutant alleles of different strength reveals multiple functions of Topoisomerase 2 in regulation of Drosophila chromosome structure. PLoS Genet 10(10): e1004739, 2014
ДОКЛАДЫ ПО ТЕМЕ ПРОЕКТА
-
Kiseleva E, Strunov A, Boldyreva LV, Pindyurin AV, Gatti M. Interactions of endoplasmic reticulum and the nuclear envelope during mitosis in Drosophila early embryo and S2 cells: an ultrastructural analysis. International mini-conference "Chromosomes and Mitosis 2016", 25.11.2016, Novosibirsk, Russia
-
Pavlova GA, Popova JV, Andreyeva EN, Pindyurin AV, Gatti M. Role of the minus-end binding proteins in kinetochore-driven microtubule growth. International mini-conference "Chromosomes and Mitosis 2016", 25.11.2016, Novosibirsk, Russia
-
Popova JV, Pavlova GA, Munzarova AF, Razuvaeva AV, Renda F, Somma P, Pindyurin AV, Gatti M. Role of Eb1, Mars, Mast and Mei-38 proteins in kinetochore-driven microtubule growth in Drosophila S2 cells. International mini-conference "Chromosomes and Mitosis 2016", 25.11.2016, Novosibirsk, Russia
-
Razuvaeva AV, Pavlova GA, Munzarova AF, Popova JV, Renda F, Somma P, Pindyurin AV, Gatti M. Analysis of the involvement of kinesin-like proteins in cell division of Drosophila S2 cells. International mini-conference "Chromosomes and Mitosis 2016", 25.11.2016, Novosibirsk, Russia
-
Munzarova AF, Popova JV, Razuvaeva AV, Shloma VV, Gatti M, Omelyanchuk LV. Measuring Microtubule Flux using the modification of a standard photobleaching-based method. International mini-conference "Chromosomes and Mitosis 2016", 25.11.2016, Novosibirsk, Russia
-
Strunov A, Boldyreva LV, Pindyurin AV, Gatti M, Kiseleva E. Microtubule dynamics in S2 cell mitosis: an ultrastructural overview. International mini-conference "Chromosomes and Mitosis 2016", 25.11.2016, Novosibirsk, Russia
-
Павлова ГА, Попова ЮВ, Мунзарова АФ, Галимова ЮА, Разуваева АВ, Ренда Ф, Сомма МП, Пиндюрин АВ, Гатти М. Факторы, обусловливающие характер повторного роста микротрубочек веретена деления после деполимеризации тубулина у Drosophila melanogaster. Poster. V Съезд биохимиков России, 04-08.10.2016, Сочи, Россия
-
Попова ЮВ, Павлова ГА, Мунзарова АФ, Разуваева АВ, Ренда Ф, Сомма МП, Пиндюрин АВ, Гатти М. Исследование генетического контроля кинетохор-зависимого роста микротрубочек в культуре клеток S2 Drosophila melanogaster при помощи РНК-интерференции. Poster. V Съезд биохимиков России, 04-08.10.2016, Сочи, Россия
-
Pavlova G, Popova J, Munzarova A, Galimova J, Razuvaeva A, Renda F, Somma P, Pindyurin A, Gatti M. Genetic dissection of kinetochore-driven microtubule formation during Drosophila spindle assembly. Italian Drosophila Research Conference, 14-16.09.2016, Bologna, Italy
-
Pavlova G, Popova J, Munzarova A, Galimova J, Razuvaeva A, Renda F, Somma P, Pindyurin A, Gatti M. The mechanisms of Drosophila spindle assembly: The role of kinetochore-driven microtubule formation. 2nd Science of the Future Conference, 20-23.09.2016, Kazan, Russia
-
Popova JV, Pavlova GA, Munzarova AF, Renda F, Somma MP, Pindyurin AV, Gatti M. Genetic control of kinetochore-driven microtubule growth: An RNAi-based analysis in Drosophila S2 cells. Poster. 2nd Science of the Future Conference, 20-23.09.2016, Kazan, Russia
-
Munzarova AF, Popova JV, Razuvaeva AV, Shloma VV, Gatti M, Omelyanchuk LV. A new method for accurate measurement of poleward microtubule flux in metaphase spindles of Drosophila S2 cells. Poster. 2nd Science of the Future Conference, 20-23.09.2016, Kazan, Russia
-
Omelyanchuk LV, Munzarova AF, Mikhailova TY. Theoretical model of mitotic spindle microtubule growth for FRAP curve interpretation. 10th International conference on Bioinformatics of Genome Regulation and Structure/Systems Biology "BGRS/SB-2016", 22-25.08.2016, Novosibirsk, Russia
-
Pavlova G, Popova J, Munzarova A, Galimova J, Razuvaeva A, Renda F, Somma P, Pindyurin A, Gatti M. The role of kinetochre-driven microtubule formation in Drosophila spindle assembly. 10th International conference on Bioinformatics of Genome Regulation and Structure/Systems Biology "BGRS/SB-2016", 22-25.08.2016, Novosibirsk, Russia
-
Strunov AA, Boldyreva LV, Pindyurin AV, Gatti M, Kiseleva E. Ultrastructural anaysis of mitotic division in Drosophila S2 cells. Poster, 10th International conference on Bioinformatics of Genome Regulation and Structure/Systems Biology "BGRS/SB-2016", 22-25.08.2016, Novosibirsk, Russia
-
Strunov AA, Boldyreva LV, Pindyurin AV, Gatti M, Kiseleva E. Ultrastructural anaysis of spindle and kinetochores in augmin-depleted Drosophila S2 cells/ Poster, 10th International conference on Bioinformatics of Genome Regulation and Structure/Systems Biology "BGRS/SB-2016", 22-25.08.2016, Novosibirsk, Russia
-
Omelyanchuk LV. Flux in mitotic spindle and FRAP curve theory. International mini-conference "Chromosomes and Mitosis 2015", 16.12.2015, Novosibirsk, Russia
-
Strunov AA. Peering into Drosophila S2 cell mitosis: new details of nuclear envelope and microtubule ultrastructural dynamics. International mini-conference "Chromosomes and Mitosis 2015", 16.12.2015, Novosibirsk, Russia
-
Galimova JA. Spindle microtubule regrowth after cold- or colcemid-induced tubulin depolymerization in Drosophila S2 cells. International mini-conference "Chromosomes and Mitosis 2015", 16.12.2015, Novosibirsk, Russia
-
Pavlova GA. The roles of microtubule destabilizing kinesins in the mechanisms underlying kinetochore-driven microtubule growth in Drosophila S2 cells. International mini-conference "Chromosomes and Mitosis 2015", 16.12.2015, Novosibirsk, Russia
-
Popova JV. The roles of EB1, MAST/ORBIT, MARS/HURP and MEI-38/TPX2 in the mechanisms underlying kinetochore-driven microtubule growth in Drosophila S2 cells. International mini-conference "Chromosomes and Mitosis 2015", 16.12.2015, Novosibirsk, Russia
-
Munzarova AF, Omelyanchuk LV. FRAP curve analisys and micrtubule flux in the mitotic spindle of D. melanogater S2 cells. 8th Russian congress of young biologists "Symbiose-Russia 2015", 05-09.10.2015, Novosibirsk, Russia
-
Pavlova GA, Munzarova AF, Popova JV, Razuvaeva AV. The role kinesin-like proteins in kinetochore-driven microtubule microtubule formation in Drosophila. Poster, 8th Russian congress of young biologists "Symbiose-Russia 2015", 05-09.10.2015, Novosibirsk, Russia
-
Попова ЮВ, Разуваева АВ, Мунзарова АФ, Павлова ГА. Исследование механизмов, лежащих в основе кинетохор-зависимого роста микротрубочек у Drosophila melanogaster: анализ роли белков EB1, MAST, MARS и MEI-38. Стендовый доклад, VIII Всероссийский с международным участием конгресс молодых учёных-биологов "Симбиоз-Россия 2015", 05-09.10.2015, Новосибирск, Россия
-
Strunov AA, Boldyreva LV, Andreeva EN, Omelyanchuk LV, Pindyurin AV, Gatti M, Kiseleva EV. Ultrastructure of microtubules during different stages of division of Drosophila melanogaster S2 cell culture. Poster, International Conference “Chromosome 2015”, 24-28.08.2015, Novosibirsk, Russia
-
Renda F, Pellacani C, Bucciarelli E, Sharp DJ, Gatti M, Somma MP. Int6 is required for proper mocrotubule dynamics at Drosophila kinetochores. Poster, International Conference “Chromosome 2015”, 24-28.08.2015, Novosibirsk, Russia
-
Popova JV, Razuvaeva AV, Munzarova AF, Pavlova GA, Pindyurin AV, Gatti M. Dissection of the mechanisms underlying kinetochore-driven microtubule growth: analysis of the roles of EB1, MAST/ORBIT, MARS/HURP and MEI-38/TPX2. Poster, International Conference “Chromosome 2015”, 24-28.08.2015, Novosibirsk, Russia
-
Munzarova AF, Pavlova GA, Popova JV, Razuvaeva AV, Pindyurin AV, Gatti M. Dissection of the mechanisms underlying kinetochore-driven microtubule growth: analysis of the roles of microtubule destabilizing kinesis. Poster, International Conference “Chromosome 2015”, 24-28.08.2015, Novosibirsk, Russia
-
Munzarova AF, Bessmeltsev VP, Vileyko VV, Omelyanchuk LV. Microtubule flux in the mitotic spindle of D. melanogaster S2 cells and FRAP curve theory. International Conference “Chromosome 2015”, 24-28.08.2015, Novosibirsk, Russia
-
Разуваева АВ. Изучение роли белков Klp67A и Mast в процессе кинетохор-зависимого роста микротрубочек у Drosophila melanogaster. XII Международная конференция студентов, аспирантов и молодых ученых “Перспективы развития фундаментальных наук”, 21-24.04.2015, Томск, Россия
-
Мунзарова АФ. Визуализация межполярных микротрубочек веретена деления клеток дрозофилы при помощи метода FRAP. 19 Международная пущинская школа-конференция молодых ученых "Биология - наука 21 века", 20-24.04.2015, Пущино, Россия
-
Павлова ГА. Поиск белков, участвующих в кинетохор-зависимом росте микротрубочек у Drosophila melanogaster. 19 Международная пущинская школа-конференция молодых ученых "Биология - наука 21 века", 20-24.04.2015, Пущино, Россия
-
Омельянчук ЛВ. Сплайсинг-факторы как позиционные регуляторы в тканях дрозофилы. XVII Всероссийский симпозиум "Структура и функции клеточного ядра", 28-30.10.2014, Санкт-Петербург, Россия
-
Gatti M. Telomeres in model organisms: similarities and differences with human telomeres. The XIII Congress of the Italian Federation of Life Sciences (FISV), 24-27.09.2014, Pisa, Italy
-
Gatti M. The mechanisms of kinetochore-driven MT formation in Drosophila. Первая международная научная конференция "Наука будущего", 17-20.09.2014, Санкт-Петербург, Россия
ПОВЫШЕНИЕ КВАЛИФИКАЦИИ СОТРУДНИКОВ
-
Семинар "Инновационные технологии для исследований в клеточной биологии" (преподаватели: сотрудники ООО "Альгимед") 31.03.2016, НИИОХ СО РАН, Новосибирск, Россия
-
Практический курс "Факторы, влияющие на характер повторного роста микротрубочек митотического веретена деления после их деполимеризации" (преподаватель: сотрудник Римского университета Sapienza Ренда Ф) 15.09.2015-16.10.2015, ИМКБ СО РАН, Новосибирск, Россия
-
Cеминары и практический курс “EMBO Practical Course: Current methods in cell biology” 14.09.2015–22.09.2015, EMBL, Heidelberg, Germany
-
Семинары и практический курс по ПЦР "NOT another PCR school 2015" (Лектор: Afif Abdel Nour, Био-Рад, Франция) 15.06.2015-16.06.2015, ИЦиГ СО РАН, Новосибирск, Россия
-
Семинары и практический курс по конфокальной микроскопии "Теория и практика имиджнга в биологических исследованиях" (преподаватели: сотрудники ООО "ОПТЭК") 26.05.2015-29.05.2015, ИЦиГ СО РАН, Новосибирск, Россия
-
Семинары и практический курс по методам пробоподготовки, концентрации и фильтрации "Интерактивная лаборатория Sartorius" (преподаватели: сотрудники ООО "Сарториус ИЦР", Новосибирск), 25.02.2015, Академпарк, Новосибирск, Россия
-
Цикл семинаров "Обработка и анализ данных на языке программирования R" (преподаватели: сотрудники ИМКБ Гончаров ФП, Иванкин АВ, Пиндюрин АВ), 11.11.2014, 25.11.2014, 09.12.2014, 03.02.2015, 17.02.2015, 03.03.2015 – 17.03.2015 ИМКБ СО РАН, Новосибирск, Россия
-
Семинары и практический курс "Теория и практика имиджинга в биологических исследованиях" (преподаватели: сотрудники ООО "ОПТЭК") 07.10.2014-10.10.2014, ИМКБ СО РАН, Новосибирск, Россия
-
Семинары и практический курс "Современные цифровые технологии в микроскопии для медицины и биологии" (преподаватели: сотрудники ООО "Олимпус Москва") 25.09.2014-26.09.2014, ИМКБ СО РАН, Новосибирск, Россия
-
Практический курс "Методы исследования кинетохор-зависимого образования микротрубочек у Drosophila" (преподаватели: сотрудники Римского университета Sapienza: Сомма МП, Ренда Ф, Гатти М) 11.04.2014-21.05.2014, 15.10.2014-28.11.2014, Италия, Рим, Римский университет Sapienza; 15.09.2014-14.11.2014, ИМКБ СО РАН, Новосибирск, Россия
ОБОРУДОВАНИЕ
- Помещение для работ с культурами клеток эукариот, многофункциональный микропланшетный ридер для детекции и индукции флуоресценции в живых клетках
- Центр световой и флуоресцентной микроскопии
- Оборудование для наработки и очистки белковых экстрактов и система для документирования гелей и блотов
- Помещение для чистых работ с ДНК-пробами (ПЦР-бокс) и система амплификации проб в реальном времени
МЕТОДИЧЕСКАЯ БАЗА
- работа с клеточными культурами дрозофилы и человека;
- РНК-интерференция генов в культивируемых клетках и в тканях дрозофилы;
- количественное определение уровня экспрессии генов (обратная транскрипция и количественная ПЦР);
- анализ повторного роста митотических микротрубочек в культивируемых клетках и в тканях дрозофилы;
- распознавание и анализ митотических фенотипов;
- получение специфических антител к исследуемым белкам;
- функциональная характеристика белок-белковых взаимодействий in vitro и in vivo;
КОНФЕРЕНЦИИ
С привлечением средств гранта были организованы следующие конференции:
 |
Международная конференция "Хромосома 2015" |
 |
Международная мини-конференция “Chromosomes and Mitosis 2015” |
 |
Международная мини-конференция “Chromosomes and Mitosis 2016” |
СМИ О ПРОЕКТЕ
 |
Цель гранта — узнать больше |
 |
Сложное деление на два газета “Наука в Сибири” 23 декабря 2015 г. |